Responsable d’équipe : Hélène Castel
 Activités de recherche
Activités de recherche
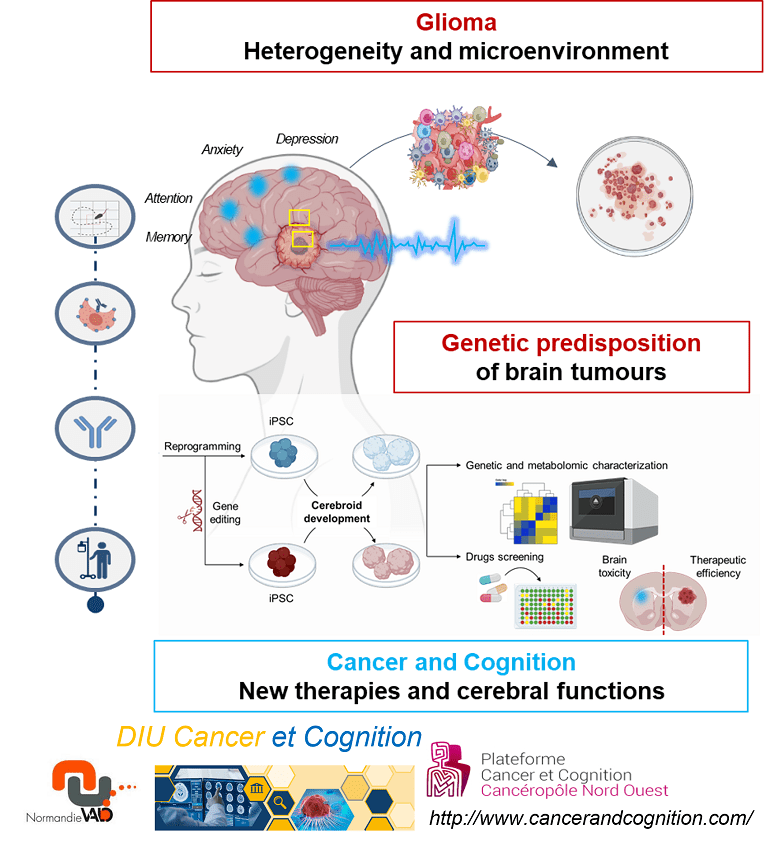
L’équipe NeuroGlio développe un programme fondamental, génétique et translationnel en Neuro-oncologie, qui vise à comprendre les mécanismes immuno-inflammatoires ou immuno-suppresseurs des cancers périphériques et cérébraux tels que les gliomes de l’adulte et de l’enfant, et la contribution du microenvironnement immunitaires et nerveux dans la résistance aux traitements. Dans ce projet global, nous recherchons des cibles originales et testons de nouvelles stratégies thérapeutiques et immunothérapies, pour associer efficacité thérapeutique et préservation/réhabilitation des fonctions cérébrales et cognitives. Nous travaillons sur deux axes complémentaires :
- Tumeurs cérébrales, microenvironnement et stratégies thérapeutiques
- Mettre une place un programme de recherche ambitieux et innovant sur les facteurs de risque génétique (Li-Fraumeni, etc…) des tumeurs cérébrales, notamment pédiatriques, dans des organoïdes cérébraux. Nous avons mis en évidence des altérations du neurodéveloppement et de la cytokinèse dans des organoïdes corticaux complexes et vasculaires, ainsi que de plexus choroïdes ou de cervelet et testons des outils et stratégies thérapeutiques ainsi que la neurotoxicité.
- Étudier par des méthodes scRNAseq et protéomiques le rôle des contraintes mécaniques dans les niches vasculaires et immunitaires sur la récidive du glioblastome
- Tester et démontrer le rôle des récepteurs couplés aux protéines G (récepteur de l’urotensine II, etc…) dans les voies pathologiques cérébrales impliquant les barrières sang-cerveau telles que la neuroinflammation dans l’hémorragie sous-arachnoïdienne ou l’angiogenèse du glioblastome dans des modèles précliniques murins KO ou KI humanisés pour le récepteur d’intérêt (récepteur UT).
- Évaluer des composés ou ligands spécifiques, biaisés, de ces récepteurs ou oligomères de récepteurs dans la prévention et/ou le traitement des pathologies inflammatoires et cérébrovasculaires, in vitro dans des modèles cellulaires recombinant et in vivo dans des modèles précliniques murins.
- Montrer l’impact de protéines G ou de protéines plate-forme (filamine A) dans l’invasion et l’agressivité du glioblastome dans des modèles de culture 2D et 3D et des tumoroïdes préparés à partir de prélèvements de gliomes de patients.
- Étudier finement le trafic vésiculaire intracellulaire orchestré par les protéines de l’autophagie ATG5 et ATG9A, et les protéines partenaires de l’ATG9 surexprimées dans le sous-type mésenchymateux du glioblastome et associée à un mauvais pronostic grâce à des méthodes de types STED et TIRF.
- Cibler les mécanismes d’invasion et récidive du glioblastome, et le rôle du microenvironnement nerveux et notamment comment une hyperexcitabilité, la conduction axonale et la substance blanche favorisent la croissance du glioblastome (enregistrements électrophysiologiques des activités axonales et méthodes optogénétiques)
- Étudier des possibilités de thérapie locales en modifiant l’environnement immunosuppresseur du glioblastome par injections de matrices, biomatériaux et hydrogels dans la cavité de résection du glioblastome ; il s’agit de créer des pièges à tumeurs à l’aide de chimiokines, de contrôler le statut inflammatoire de macrophages tumoraux et de permettre une réparation tissulaire pendant le traitement.
- Impact du cancer et des thérapies du cancer sur les fonctions neurobiologiques et cognitives
- Étudier le rôle des thérapies hormonales de nouvelle génération sur la réactivité émotionnelle, les fonctions cognitives et la neurofatigue chez des souris âgées et d’une chimiothérapie sur la dérégulation de l’équilibre du microbiote intestinal, l’inflammation systémique et la neuroinflammation, responsables d’une « neurofatigue » et de déficits cognitifs.
- Démontrer le rôle des vésicules extracellulaires du cancer sur les fonctions cognitives et la neuroinflammation dans des modèles précliniques comportementaux porteurs de tumeurs.
- Évaluer le rôle de différents cancers périphériques, inflammatoires ou immuno-déserts en combinaison avec de nouvelles immunothérapies sur les fonctions cognitives chez la souris dans des modèles précliniques.
- Évaluer des modèles organoïdes de cancers du cerveau (gliome) ou de pancréas, le rôle de la régulation nerveuse sur la croissance tumorale à l’aide d’assembloïdes cancer-nerf/cortex mais aussi des modèles animaux comportementaux.
La force de l’équipe NeuroGlio réside dans des expertises complémentaires et multidisciplinaires en biologie moléculaire et cellulaire ciblant la migration et l’invasion des cellules cancéreuses, dans le design et la validation d’outils d’imagerie cellulaire dynamique, dans la mise en place de modèles murins comportementaux porteurs de cancers, en électrophysiologie sur tranche organotypiques et in vivo, voire en optogénétique, mais aussi dans le développement d’organoïdes et de cérébroïdes, des stratégies et modèles que nous souhaitons mettre au service de nos projets de recherche sur l’oncogenèse cérébrale, et de la communauté.
 Publications phares
Publications phares
Brevet : FR2311618- 25/10/2023 : Castel H., Mutel A., Bonin M-A., Leduc R. Lecointre C. and Morin F. Construction comprenant ou constituée d’une séquence peptidique apte à inhiber l’interaction de la filamine A avec le récepteur UT – composition pharmaceutique et produis associés dans le cancer.
Nicola C, Pedard, Dubois M, Desrues L, Neveu P, Riou G, Johnston I, Dembele PK, Lecras P, Vaudry D, Adriouch S, Joly F, Hilber P, Wurtz O, Castel H. Anti-PD-1/PD-L1 Therapy Triggers Cognitive Deficits and Anxiety-Like Behaviors Through Tumor-Initiated Neuroinflammatory Niches in Male Mice. Bioarchive. doi.org/10.1101/2025.09.03.673981.
Pedard L, Prevost, Carpena C, Holleran B, L, Dubois M, Nicola C, Gruel R, Desrues L, Godefroy D, Deffieux T, Tanter M, Ali C, Leduc R, Prézeau L, Gandolfo P, Morin F, Wurtz O, Bonnard T, Vivien D and Castel H. Early expression of the urotensin II receptor in meninges drives cerebrovascular disorders, perivascular macrophages and neuroinflammation in subarachnoid hemorrhage. NATURE COMMUNICATIONS, accepted.
Parment R, Dubois M, Desrues L, Mutel A, Dembélé KP, Belin N, Tron L, Guérin C, Coëffier M, Compère V, Féger C, Joly F, Hilber P, Ribet D, Castel H. A Panax quinquefolius-Based Preparation Prevents the Impact of 5-FU on Activity/Exploration Behaviors and Not on Cognitive Functions Mitigating Gut Microbiota and Inflammation in Mice. CANCERS (Basel). 2022 Sep 10;14(18):4403. doi: 10.3390/cancers14184403. PMID: 36139563; PMCID: PMC9496716.
Campisi D, Desrues L, Dembélé KP, Mutel A, Parment R, Gandolfo P, Castel H, Morin F. The core autophagy protein ATG9A controls dynamics of cell protrusions and directed migration. JOURNAL CELL BIOLOGY. 2022 Mar 7;221(3):e202106014. doi: 10.1083/jcb.202106014. Epub 2022 Feb 18.
Kasapidou PM, de Montullé EL, Dembélé KP, Mutel A, Desrues L, Gubala V, Castel H. Hyaluronic acid-based hydrogels loaded with chemoattractant and anticancer drug – new formulation for attracting and tackling glioma cells. SOFT MATTER. 2021 Dec 15;17(48):10846-10861. doi: 10.1039/d1sm01003d.
Nicola C, Dubois M, Campart C, Al Sagheer T, Desrues L, Schapman D, Galas L, Lange M, Joly F, Castel H. The Prostate Cancer Therapy Enzalutamide Compared with Abiraterone Acetate/Prednisone Impacts Motivation for Exploration, Spatial Learning and Alters Dopaminergic Transmission in Aged Castrated Mice. CANCERS (Basel). 2021 Jul 14;13(14):3518. doi: 10.3390/cancers13143518.
Le Joncour V, PO, Dembélé KP, Mutel A, Perzo N, Campisi D, Desrues L, Modzelewski R, Couraud PO, Ferracci FX, Marguet F, Laquerrière A, Vera P, Bohn P, Langlois O, Morin F, Gandolfo P* and Castel H. Targeting the urotensin II/UT G protein-coupled receptor to counteract angiogenesis and mesenchymal hypoxia/necrosis in glioblastoma. FRONTIERS in CELL DEVELOPMENT and BIOLOGY, 2021, 10.3389/fcell.2021.652544.
Poret B, Desrues L, Bonin MA, Pedard M, Dubois M, Leduc R, Modzelewski R, Decazes P, Morin F, Vera P, Castel H, Bohn P, Gandolfo P. Development of novel 111-In-labeled DOTA urotensin II analogues for targeting the UT receptor overexpressed in solid tumours. BIOMOLECULES, 2020, 10: 471.
Coly PM, Perzo N, Le Joncour V, Lecointre C, Schouft MT, Desrues L, Tonon MC, Wurtz O, Gandolfo P, Castel H, Morin F. Chemotactic G protein-coupled receptors control cell migration by repressing autophagosome biogenesis. AUTOPHAGY, 2016, 12:2344-2362.
Lecointre C, Desrues L, Joubert JE, Perzo N, Guichet PO, Le Joncour V, Brulé C, Chabbert M, Leduc R, Prézeau L, Laquerrière A, Proust F, Gandolfo P, Morin F and Castel H. Signaling switch of the urotensin II vasosactive peptide GPCR: prototypic chemotaxic mechanism in glioma. ONCOGENE, 2015, 34:5080-94.
 Membres
Membres
Direction et assistante
Chercheurs – Enseignants-Chercheurs – Cliniciens
Post Doctorants
 Contact
Contact
CBG – Cancer and Brain Genomics – UMR1245
Bâtiment CURIB
Université de Rouen Normandie
25 rue Lucien Tesnières
76821 Mont-Saint-Aignan
Hélène Castel
helene.castel@univ-rouen.fr
Tel : +33 2 35 14 66 23
Mélanie Shaiek
melanie.shaiek@univ-rouen.fr
Tel : + 33 2 35 14 67 33




























